Diagrama de Bohr
Resulta imposible pasar por alto los grandes avances científicos que la humanidad podido alcanzar en los últimos cien años, pues nunca en su historia el hombre sobre la tierra había sido capaz siquiera de soñar con surcar los cielos empleando aeronaves, ni mucho menos poner un pie sobre la luna en los albores de su incipiente periplo espacial.
Es gracias los descubrimientos de hombres como Niels Bohr que la física pudo avanzar a un ritmo realmente vertiginoso, con el desarrollo del campo cuántico se han abierto un sinfín de posibilidades, pues con los principios de la física clásica eran imposibles de considerar.
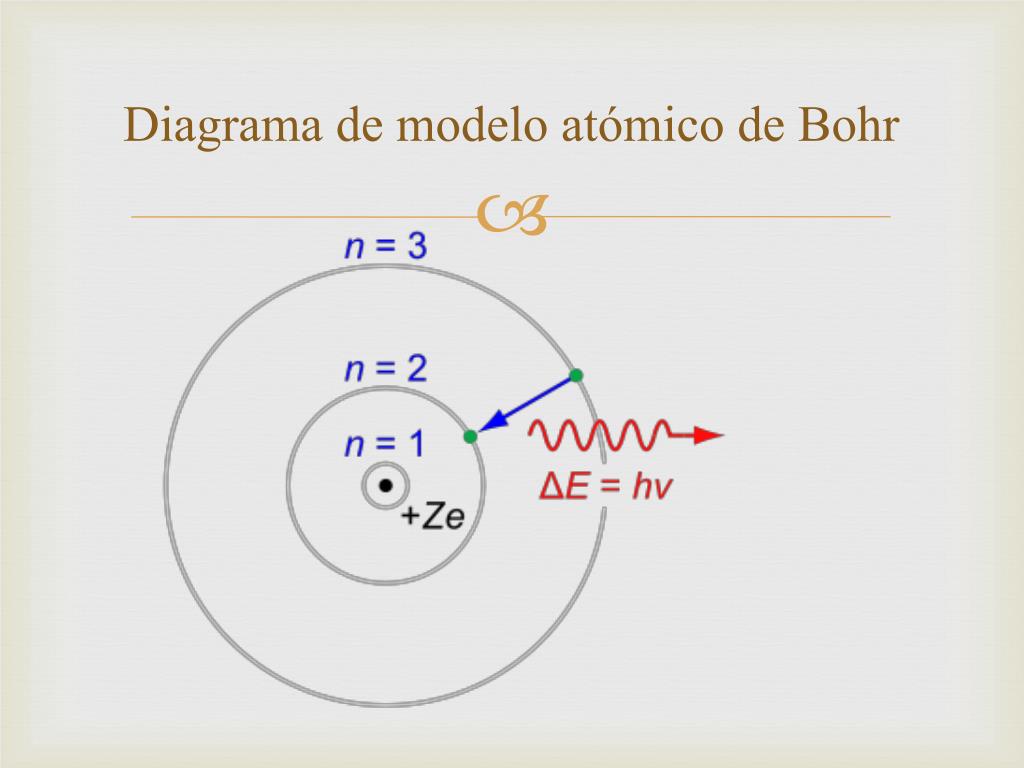
A principios del siglo XX este científico propuso su famoso diagrama de Bohr para explicar el funcionamiento de partículas simples, revolucionando a la física. Si deseas conocer un poco más acerca de este interesante tema, entonces no dejes de leer este artículo.
¿En que se basa el diagrama de Bohr?
El diagrama de Bohr surgió como un intento del físico danés Niels Bohr por obtener una teoría aceptable y coherente en relación a la estabilidad que debía alcanzar la materia, para integrar los elementos o bloques primarios más básicos a través de los cuales se edifican cualquier tipo de estructura en el universo; estamos hablando sin duda alguna de los átomos.
Para lograr su meta Bohr tomó como objeto de estudio a uno de los elementos más sencillos, desde el punto de vista estructural, conocidos hasta el momento: el átomo de hidrógeno. En ese entonces se sabía que el hidrógeno poseía una estructura integrada por un núcleo sobre el cual orbitaba un único electrón.
Bohr tomó las ideas esbozadas por otros colegas como Albert Einstein o Max Planck, los cuales habían solo unos años antes sembrado las bases de la teoría cuántica.
El principal problema que tenía Bohr era que de acuerdo a los postulados de la física clásica las partículas cargadas negativamente como es el caso de los electrones, debían anularse al acercarse a un núcleo ocupado por un protón.

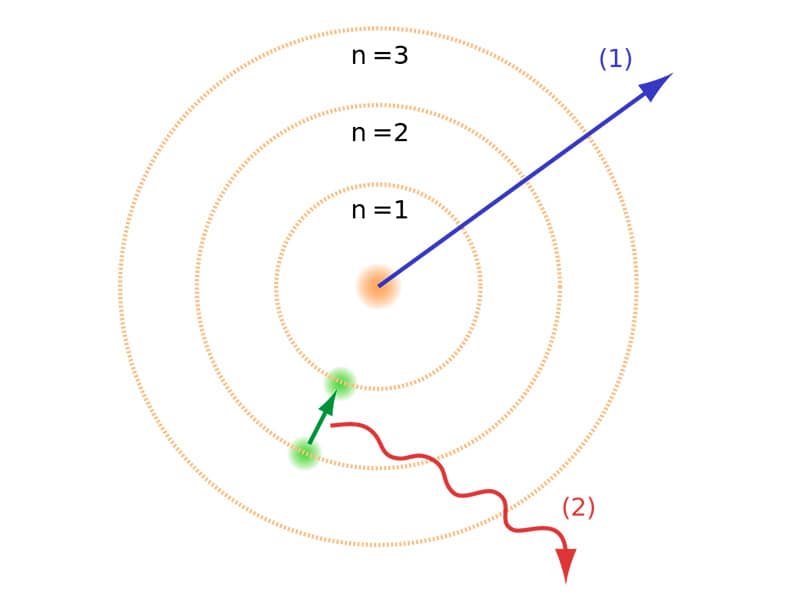
Para sortear este inconveniente, este brillante científico propuso su diagrama de Bohr donde graficó un modelo atómico en el cual los electrones eran capaces de gravitar alrededor el núcleo surcando órbitas de menor energía. Cada uno de los electrones podía girar en torno a una órbita específica caracterizada por un nivel energético en particular.
En un diagrama de Bohr el momento angular de los electrones se encuentra cuantizado, para calcular la distancia a la cual están ubicadas las diversas órbitas en relación al núcleo Bohr determinó que el momento angular variaba en función de la constante de Plank, pudiendo establecer un número cuántico principal asociado a la variable “n” que establecía el nivel energético de cada orbital.
Gracias a los avances obtenidos en sus estudios, el diagrama de Bohr se convirtió en un instrumento que permitió determinar que cada electrón ocupa orbitales de acuerdo a su nivel energético y que pueden saltar de un orbital a otro cuando son liberados.
Esperamos que este artículo te haya permitido conocer un poco más acerca del diagrama de Bohr y su importancia para el avance de la física moderna. Si la información te ha parecido interesante no dudes en compartirla a través de tus redes sociales.
¡Por cierto! Antes de que te vayas, queremos recomendarte esto que seguro que te interesa:
- Diagrama de dispersión
- Tipos de diagrama
- Diagrama de estratificación
- Diagrama de funcionamiento
- Diagrama de estados
- Diagrama de sankey
- Diagrama de sectores
- Diagrama de flujo de una cafetería
- Diagrama eléctrico
Son una serie de contenidos a parte del que has leído que puede ser interesante para tí ¡Muchas gracias por leernos!
